Grafik energi ionisasi periode 3.
Jika kamu sedang mencari artikel grafik energi ionisasi periode 3 terlengkap, berarti kamu telah berada di blog yang tepat. Yuk langsung saja kita simak ulasan grafik energi ionisasi periode 3 berikut ini.
 Grafikdibawah Iniyang Men Lihat Cara Penyelesaian Di Qanda From qanda.ai
Grafikdibawah Iniyang Men Lihat Cara Penyelesaian Di Qanda From qanda.ai
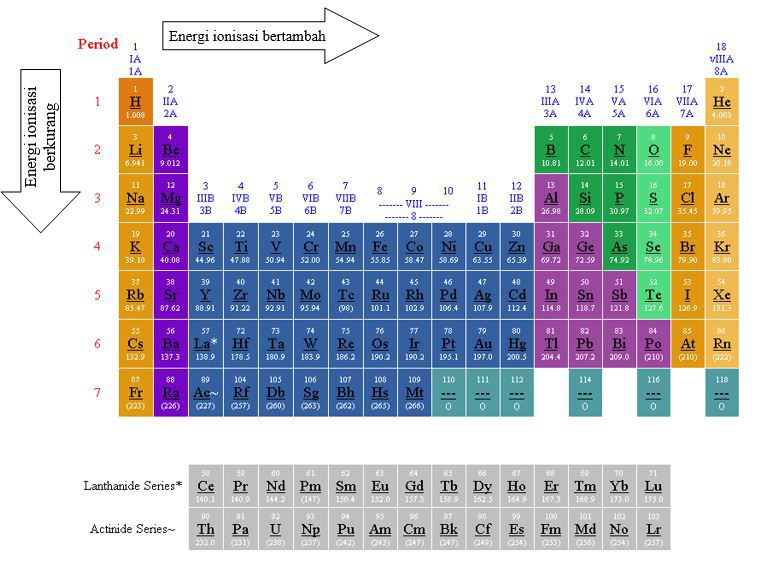
Bila tidak ada keterangan khusus maka yang disebut energi ionisasi adalah energi ionisasi pertama. EI diperlukan untuk mengatasi gaya tarik-menarik oleh inti atom yang bermuatan positif. Akan tetapi energi ionisasi Al lebih rendah dari energi ionisasi Mg dan energi ionisasi S lebih rendah dari P. Dalam satu periode dari kiri ke kanan energi ionisasi cenderung bertambah.
Pengertian Energi ionisasi.
Seiring dengan bertambahnya jumlah elektron valensi kekuatan ikatan logam meningkat dari natrium hingga alumunium. Oleh karena itu titik cair dan titik didihnya meningkat. Berikut grafik energi inonisasi pertama dari unsur unsur periode 3. Bila tidak ada keterangan khusus maka yang disebut energi ionisasi adalah energi ionisasi pertama. Pengertian Energi ionisasi.
 Source: cerpenindoe.blogspot.com
Source: cerpenindoe.blogspot.com
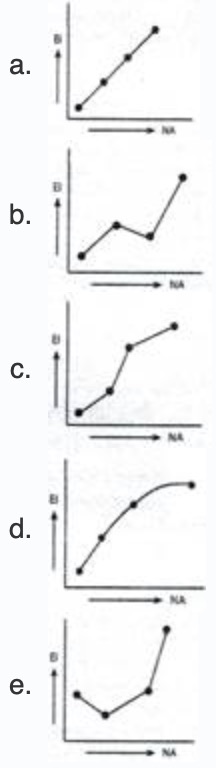
Oleh karena itu titik cair dan titik didihnya meningkat. Akan tetapi energi ionisasi Al lebih rendah dari energi ionisasi Mg dan energi ionisasi S lebih rendah dari P. Begitu juga dengan P dan S unsur Pmempunyai energi ionisasi lebih besar daripada S karena P mempunyai subkulit setengah penuh yang lebih stabil. Energi ionsisasi yang akan dibahas kali ini meliputi pengertian energi ionisasi dan grafik energi ionisasi. Grafik yang tepat menggambarkan hubungan nomor atom dengan energi ionisasi adalah.
Akan tetapi energi ionisasi Al lebih rendah dari energi ionisasi Mg dan energi ionisasi S lebih rendah dari P.
Gambar 37 Grafik energi ionisasi unsur-unsur periode ketiga Natrium magnesium dan alumunium mempunyai ikatan logam. Enegri ionisasi pertama adalah energi yang dibutuhkan untuk melepaskan sebuah elektron terluar dari suatu atom dalam keadaan gas dan akan menghasilkan 1 mol gas ionnya. Gambar 37 Grafik energi ionisasi unsur-unsur periode ketiga Natrium magnesium dan alumunium mempunyai ikatan logam. EI diperlukan untuk mengatasi gaya tarik-menarik oleh inti atom yang bermuatan positif.

Berikut grafik energi inonisasi pertama dari unsur unsur periode 3. Dalam satu periode dari kiri ke kanan energi ionisasi cenderung bertambah. Cara Menentukan Golongan Unsur Berdasarkan Energi Ionisasi Saat belajar di kelas X dan mempelajari Tabel Periodik Unsur khususnya mengenai sifat dan karakteristik unsur dalam suatu periode dan atau golongan seringkali guru mengajarkan hafalan kecenderungan energi ionisasi keelektronegatifan afinitas jari-jari dan lain-lain. Begitu juga dengan P dan S unsur Pmempunyai energi ionisasi lebih besar daripada S karena P mempunyai subkulit setengah penuh yang lebih stabil.
 Source: qanda.ai
Source: qanda.ai
Penyimpangan ini terjadi karena. Berikut grafik energi inonisasi pertama dari unsur unsur periode 3. Energi ionisasi dari kiri ke kanan semakin besar. Energi ionisasi Mg lebih besar daripada Al karena Mg mempunyai elektron valensi yang sudah berpasangan semua penuh.
 Source: qanda.ai
Source: qanda.ai
Akan tetapi energi ionisasi Al lebih rendah dari energi ionisasi Mg dan energi ionisasi S lebih rendah dari P. Dapat disimpulkan keperiodikan energi ionisasi sebagai berikut. Oleh karena itu titik cair dan titik didihnya meningkat. Bagi kalian yang sering ketuker tentang kecenderungan keempat sifat ini pada Sistem Periodik Unsur semoga setelah menonton video ini kalian gak lagi.
Grafik yang tepat menggambarkan hubungan nomor atom dengan energi ionisasi adalah. Bila tidak ada keterangan khusus maka yang disebut energi ionisasi adalah energi ionisasi pertama. Energi ionisasi Mg lebih besar daripada Al karena Mg mempunyai elektron valensi yang sudah berpasangan semua penuh. Seiring dengan bertambahnya jumlah elektron valensi kekuatan ikatan logam meningkat dari natrium hingga alumunium.
Hal ini disebabkan oleh susunan elektron dalam orbital yang penuh atau setengah penuh memiliki kestabilan yang lebih besar.
Bagi kalian yang sering ketuker tentang kecenderungan keempat sifat ini pada Sistem Periodik Unsur semoga setelah menonton video ini kalian gak lagi. Dalam satu periode yang sama bila dibandingkan dengan unsur golongan alkali tanah maka unsur alkali mempunyai sifat-sifat. Dalam satu golongan dari atas ke bawah energi ionisasi semakin berkurang. Misal dalam satu periode dari kiri ke kanan energi. Cara Menentukan Golongan Unsur Berdasarkan Energi Ionisasi Saat belajar di kelas X dan mempelajari Tabel Periodik Unsur khususnya mengenai sifat dan karakteristik unsur dalam suatu periode dan atau golongan seringkali guru mengajarkan hafalan kecenderungan energi ionisasi keelektronegatifan afinitas jari-jari dan lain-lain.
Enegri ionisasi pertama adalah energi yang dibutuhkan untuk melepaskan sebuah elektron terluar dari suatu atom dalam keadaan gas dan akan menghasilkan 1 mol gas ionnya. Silikon mempunyai struktur kovalen raksasa seperti. Gambar 37 Grafik energi ionisasi unsur-unsur periode ketiga Natrium magnesium dan alumunium mempunyai ikatan logam. Enegri ionisasi pertama adalah energi yang dibutuhkan untuk melepaskan sebuah elektron terluar dari suatu atom dalam keadaan gas dan akan menghasilkan 1 mol gas ionnya. EI diperlukan untuk mengatasi gaya tarik-menarik oleh inti atom yang bermuatan positif.
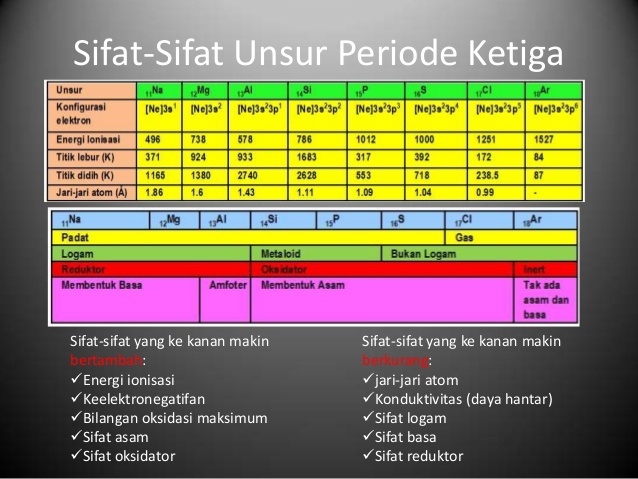
Bagi kalian yang sering ketuker tentang kecenderungan keempat sifat ini pada Sistem Periodik Unsur semoga setelah menonton video ini kalian gak lagi. 3 Energi Ionisasi Secara umum energi ionisasi unsur periode ketiga dari kiri ke kanan meningkat. Oleh karena itu titik cair dan titik didihnya meningkat. Misal dalam satu periode dari kiri ke kanan energi.
Silikon mempunyai struktur kovalen raksasa seperti.
Seiring dengan bertambahnya jumlah elektron valensi kekuatan ikatan logam meningkat dari natrium hingga alumunium. Enegri ionisasi pertama adalah energi yang dibutuhkan untuk melepaskan sebuah elektron terluar dari suatu atom dalam keadaan gas dan akan menghasilkan 1 mol gas ionnya. Unsur periode 3 adalah unsur-unsur pada baris atau periode ketiga tabel periodik. Dapat disimpulkan keperiodikan energi ionisasi sebagai berikut.
 Source: slidetodoc.com
Source: slidetodoc.com
3 Energi Ionisasi Secara umum energi ionisasi unsur periode ketiga dari kiri ke kanan meningkat. Energi ionisasi dari kiri ke kanan semakin besar. Dalam satu periode dari kiri ke kanan energi ionisasi cenderung bertambah. Silikon mempunyai struktur kovalen raksasa seperti.
 Source: qanda.ai
Source: qanda.ai
Energi ionisasi EI adalah energi yang dibutuhkan untuk memindahkan satu elektron terluar dari atom dalam keadaan gas. Gambar 37 Grafik energi ionisasi unsur-unsur periode ketiga Natrium magnesium dan alumunium mempunyai ikatan logam. Grafik yang tepat menggambarkan hubungan nomor atom dengan energi ionisasi adalah. Kecenderungan energi ionisasi unsur-unsur periode ketiga dari kiri ke kanan cenderung bertambah namun terjadi penyimpangan pada energi ionisasi magnesium dan fosforus.

Gambar 37 Grafik energi ionisasi unsur-unsur periode ketiga Natrium magnesium dan alumunium mempunyai ikatan logam. Oleh karena itu titik cair dan titik didihnya meningkat. Gambar 37 Grafik energi ionisasi unsur-unsur periode ketiga Natrium magnesium dan alumunium mempunyai ikatan logam. Pengertian Energi ionisasi.
Grafik yang tepat menggambarkan hubungan nomor atom dengan energi ionisasi adalah.
Oleh karena itu titik cair dan titik didihnya meningkat. Grafik yang tepat menggambarkan hubungan nomor atom dengan energi ionisasi adalah. Dalam satu golongan dari atas ke bawah energi ionisasi semakin berkurang. Tabel periodik disusun dalam baris-baris untuk menggambarkan keberulangan tren periodik sifat kimia unsur-unsur seiring kenaikan nomor atom. Seiring dengan bertambahnya jumlah elektron valensi kekuatan ikatan logam meningkat dari natrium hingga alumunium.

Gambar 37 Grafik energi ionisasi unsur-unsur periode ketiga Natrium magnesium dan alumunium mempunyai ikatan logam. Bila tidak ada keterangan khusus maka yang disebut energi ionisasi adalah energi ionisasi pertama. Energi ionsisasi yang akan dibahas kali ini meliputi pengertian energi ionisasi dan grafik energi ionisasi. Gambar 37 Grafik energi ionisasi unsur-unsur periode ketiga Natrium magnesium dan alumunium mempunyai ikatan logam. Hal ini disebabkan oleh susunan elektron dalam orbital yang penuh atau setengah penuh memiliki kestabilan yang lebih besar.
Enegri ionisasi pertama adalah energi yang dibutuhkan untuk melepaskan sebuah elektron terluar dari suatu atom dalam keadaan gas dan akan menghasilkan 1 mol gas ionnya.
Unsur periode 3 adalah unsur-unsur pada baris atau periode ketiga tabel periodik. Penyimpangan ini terjadi karena. Gambar 37 Grafik energi ionisasi unsur-unsur periode ketiga Natrium magnesium dan alumunium mempunyai ikatan logam. Oleh karena itu titik cair dan titik didihnya meningkat.
 Source: siswapelajar.com
Source: siswapelajar.com
Grafik yang tepat menggambarkan hubungan nomor atom dengan energi ionisasi adalah. Dapat disimpulkan keperiodikan energi ionisasi sebagai berikut. Silikon mempunyai struktur kovalen raksasa seperti. Dalam satu periode yang sama bila dibandingkan dengan unsur golongan alkali tanah maka unsur alkali mempunyai sifat-sifat.
 Source: slidetodoc.com
Source: slidetodoc.com
Oleh karena itu titik cair dan titik didihnya meningkat. Gambar 37 Grafik energi ionisasi unsur-unsur periode ketiga Natrium magnesium dan alumunium mempunyai ikatan logam. Begitu juga dengan P dan S unsur Pmempunyai energi ionisasi lebih besar daripada S karena P mempunyai subkulit setengah penuh yang lebih stabil. Energi ionisasi EI adalah energi yang dibutuhkan untuk memindahkan satu elektron terluar dari atom dalam keadaan gas.

Tabel periodik disusun dalam baris-baris untuk menggambarkan keberulangan tren periodik sifat kimia unsur-unsur seiring kenaikan nomor atom. Silikon mempunyai struktur kovalen raksasa seperti. Tabel periodik disusun dalam baris-baris untuk menggambarkan keberulangan tren periodik sifat kimia unsur-unsur seiring kenaikan nomor atom. Dalam satu periode yang sama bila dibandingkan dengan unsur golongan alkali tanah maka unsur alkali mempunyai sifat-sifat.
Silikon mempunyai struktur kovalen raksasa seperti.
Oleh karena itu titik cair dan titik didihnya meningkat. Gambar 37 Grafik energi ionisasi unsur-unsur periode ketiga Natrium magnesium dan alumunium mempunyai ikatan logam. EI diperlukan untuk mengatasi gaya tarik-menarik oleh inti atom yang bermuatan positif. Cara Menentukan Golongan Unsur Berdasarkan Energi Ionisasi Saat belajar di kelas X dan mempelajari Tabel Periodik Unsur khususnya mengenai sifat dan karakteristik unsur dalam suatu periode dan atau golongan seringkali guru mengajarkan hafalan kecenderungan energi ionisasi keelektronegatifan afinitas jari-jari dan lain-lain. Hal ini disebabkan oleh susunan elektron dalam orbital yang penuh atau setengah penuh memiliki kestabilan yang lebih besar.
 Source: qanda.ai
Source: qanda.ai
Gambar 37 Grafik energi ionisasi unsur-unsur periode ketiga Natrium magnesium dan alumunium mempunyai ikatan logam. Seiring dengan bertambahnya jumlah elektron valensi kekuatan ikatan logam meningkat dari natrium hingga alumunium. Pengertian Energi ionisasi. Dalam satu periode dari kiri ke kanan energi ionisasi cenderung bertambah. Energi ionsisasi yang akan dibahas kali ini meliputi pengertian energi ionisasi dan grafik energi ionisasi.
Seiring dengan bertambahnya jumlah elektron valensi kekuatan ikatan logam meningkat dari natrium hingga alumunium.
Dalam satu periode dari kiri ke kanan energi ionisasi cenderung bertambah. EI diperlukan untuk mengatasi gaya tarik-menarik oleh inti atom yang bermuatan positif. Silikon mempunyai struktur kovalen raksasa seperti. Cara Menentukan Golongan Unsur Berdasarkan Energi Ionisasi Saat belajar di kelas X dan mempelajari Tabel Periodik Unsur khususnya mengenai sifat dan karakteristik unsur dalam suatu periode dan atau golongan seringkali guru mengajarkan hafalan kecenderungan energi ionisasi keelektronegatifan afinitas jari-jari dan lain-lain.

Kecenderungan energi ionisasi unsur-unsur periode ketiga dari kiri ke kanan cenderung bertambah namun terjadi penyimpangan pada energi ionisasi magnesium dan fosforus. Seiring dengan bertambahnya jumlah elektron valensi kekuatan ikatan logam meningkat dari natrium hingga alumunium. Unsur periode 3 adalah unsur-unsur pada baris atau periode ketiga tabel periodik. Berikut grafik energi inonisasi pertama dari unsur unsur periode 3. Akan tetapi energi ionisasi Al lebih rendah dari energi ionisasi Mg dan energi ionisasi S lebih rendah dari P.
 Source: qanda.ai
Source: qanda.ai
Hal ini disebabkan oleh susunan elektron dalam orbital yang penuh atau setengah penuh memiliki kestabilan yang lebih besar. Dalam satu periode yang sama bila dibandingkan dengan unsur golongan alkali tanah maka unsur alkali mempunyai sifat-sifat. Oleh karena itu titik cair dan titik didihnya meningkat. Seiring dengan bertambahnya jumlah elektron valensi kekuatan ikatan logam meningkat dari natrium hingga alumunium. Oleh karena itu titik cair dan titik didihnya meningkat.

Enegri ionisasi pertama adalah energi yang dibutuhkan untuk melepaskan sebuah elektron terluar dari suatu atom dalam keadaan gas dan akan menghasilkan 1 mol gas ionnya. Silikon mempunyai struktur kovalen raksasa seperti. Dalam satu golongan dari atas ke bawah energi ionisasi semakin berkurang. Oleh karena itu titik cair dan titik didihnya meningkat. Akan tetapi energi ionisasi Al lebih rendah dari energi ionisasi Mg dan energi ionisasi S lebih rendah dari P.
Situs ini adalah komunitas terbuka bagi pengguna untuk berbagi apa yang mereka cari di internet, semua konten atau gambar di situs web ini hanya untuk penggunaan pribadi, sangat dilarang untuk menggunakan artikel ini untuk tujuan komersial, jika Anda adalah penulisnya dan menemukan gambar ini dibagikan tanpa izin Anda, silakan ajukan laporan DMCA kepada Kami.
Jika Anda menemukan situs ini lengkap, tolong dukung kami dengan membagikan postingan ini ke akun media sosial seperti Facebook, Instagram dan sebagainya atau bisa juga simpan halaman blog ini dengan judul grafik energi ionisasi periode 3 dengan menggunakan Ctrl + D untuk perangkat laptop dengan sistem operasi Windows atau Command + D untuk laptop dengan sistem operasi Apple. Jika Anda menggunakan smartphone, Anda juga dapat menggunakan menu laci dari browser yang Anda gunakan. Baik itu sistem operasi Windows, Mac, iOS, atau Android, Anda tetap dapat menandai situs web ini.